Bron: brouw-bier.nl - Alles wat de amateur bierbrouwer of bierliefhebber moet weten over het brouwen van bier bierliefhebber moet weten over het brouwen van bier
Al het materiaal om ons heen is opgebouwd uit, wat we noemen elementen, die bestaan uit 1 type atoom. Bijvoorbeeld, diamant en grafiet bestaan uit koolstof atomen. Puur goud bestaat uit alleen maar goud
atomen. De oude Griekse filosofen hadden al een idee, dat alle materie opgebouwd moest zijn uit deeltjes die niet verder te splitsen waren. Tegenwoordig weten we dat een atoom bestaat uit 3 onderdelen:
Een atoom bestaat uit een kern, met daarin o.a. de protonen. Elk atoom heeft minstens 1 proton, het verschil van de elementen wordt bepaald door het aantal protonen. Bijvoorbeeld waterstof heeft 1 proton,
helium heeft er 2 en koolstof heeft er 6. Een proton heeft een elektrische lading van +1.
De neutronen vinden we ook in de kern van een atoom. Deze hebben geen elektrische lading.
De elektronen bevinden zich in een aantal banen, schillen, om de kern van een atoom. Elke schil om de kern kan een bepaald maximum aantal elektronen bevatten. De binnenste schil heeft bijvoorbeeld maar
plaats voor 2 elektronen, de daarop volgende schil kan er 8 hebben. Deze deeltje hebben een elektrisch lading van -1.
Bij de elementen is in het atoom, het aantal elektronen gelijk aan het aantal protonen, waardoor de totale lading van het atoom neutraal is. Op grond van het aantal protonen, is het zogenaamde periodiek
systeem gemaakt, waarin alle elementen die bekend zijn, zijn weergegeven.
|
I A
|
|
VIII A
|
| 1
|
H
|
II A
|
|
III A
|
IV A
|
V A
|
VI A
|
VII A
|
He
|
| 2
|
Li
|
Be
|
|
B
|
C
|
N
|
O
|
F
|
Ne
|
| 3
|
Na
|
Mg
|
III B
|
IV B
|
V B
|
VI B
|
VII B
|
VIII B
|
I B
|
II B
|
Al
|
Si
|
P
|
S
|
Cl
|
Ar
|
| 4
|
K
|
Ca
|
Sc
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
Cu
|
Zn
|
Ga
|
Ge
|
As
|
Se
|
Br
|
Kr
|
| 5
|
Rb
|
Sr
|
V
|
Zr
|
Nb
|
Mo
|
Tc
|
Ru
|
Rh
|
Pd
|
Ag
|
Cd
|
In
|
Sn
|
Sb
|
Te
|
I
|
Xe
|
| 6
|
Cs
|
Ba
|
Ls
|
Hf
|
Ta
|
W
|
Re
|
Os
|
Ir
|
Pt
|
Au
|
Hg
|
Tl
|
Pb
|
Bi
|
Po
|
At
|
Rn
|
| 7
|
Fr
|
Ra
|
Ac
|
|
|
|
Ce
|
Pr
|
Nd
|
Pm
|
Sm
|
Eu
|
Gd
|
Tb
|
Dy
|
Ho
|
Er
|
Tm
|
Yb
|
Lu
|
|
|
Th
|
Pa
|
U
|
Np
|
Pu
|
Am
|
Cm
|
Bk
|
Cf
|
Es
|
Fm
|
Md
|
No
|
Lr
|
De (Romeinse) getallen boven de kolommen, geven het aantal elektronen aan, in de buitenste elektronenschil om de kern. De nummers voor de rijen, geeft het aantal elektronenschillen aan. Dus, waterstof
(H), in kolom I A en rij 1, heeft 1 elektronenschil met 1 elektron. Koolstof (C) in kolom IV A en rij 2, heeft 2 elektronenschillen, met in de eerste schil 2 elektronen en in de tweede (en buitenste)
schil 4 elektronen.
Een algemene regel is dat de atomen ernaar zullen streven, om de buitenste elektronenschil vol te hebben, door elektronen op te nemen, of af te staan. Elementen zoals helium (He), neon (Ne) en argon (Ar)
hebben al 8 elektronen in hun buitenste schil. Deze elementen worden ook wel edelgassen genoemd en gaan bijna geen verbindingen aan met andere elementen. Elementen zoals koolstof (C), zal graag 4 elektronen
extra willen hebben en natrium (Na) zal graag 1 elektron afstaan, om de buitenste schillen vol te krijgen. Hierdoor gaan de elementen onderling reacties aan en vormen zich verbindingen.
Een ion verbinding wordt gecreëerd wanneer de atomen ionen worden, door elektronen op te nemen of af te staan. Een voorbeeld hiervan is keukenzout, NaCl. Hierbij heeft natrium (Na), met 1 elektron in
de buitenste elektronenschil, een elektron afgestaan en krijgt hierdoor de lading +1 (1 proton meer dan het aantal elektronen). Chloride (Cl) met 7 elektronen in de buitenste schil neemt graag een elektron
op, om deze buitenste schil vol te krijgen. Hierdoor zal de lading van chloride komen op -1 (1 elektron meer, dan het aantal protonen in de kern). Doordat ionen met tegenovergestelde lading, zoals Cl-
en Na+, elkaar waardoor bijvoorbeeld keukenzout in water, een oplossing vormt van Na en Cl ionen.
Covalente verbindingen ontstaan, wanneer de atomen de elektronen onderling verdelen. Koolstof (C) uit groep IV A, met dus 4 elektronen in de buitenste schil, zal graag 4 elektronen kwijt raken, of 4 extra
willen opnemen. Een alternatief is, dat koolstof zijn elektronen deelt met een ander atoom
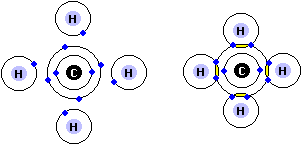 Covalente binding
Covalente binding
Hierboven zien we methaan, waarbij koolstof (C) een covalente verbinding heeft met 4 waterstof (H) atomen. Het verdelen van 1 enkele elektronenpaar, wordt een enkele binding genoemd. Er zijn ook moleculen,
met dubbele of driedubbele bindingen. In de onderstaande tabel worden een aantal voorbeelden getoond van covalente verbindingen, hoe de elektronen verdeeld zijn en de gebruikelijke notatie van deze verbindingen.
O2 - Zuurstof
N2 - Stikstof
H2O - Water
CH4 - Methaan
Meer informatie
Mooie periodiek systemen zijn verder op internet te vinden bij: